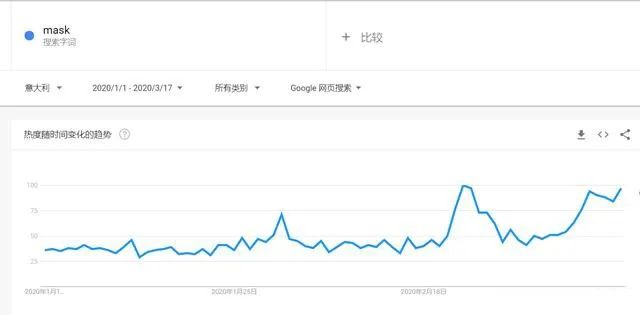
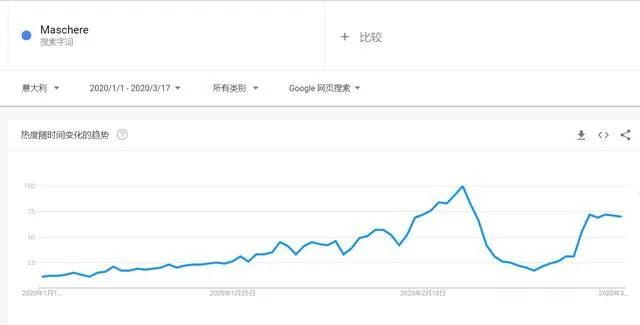
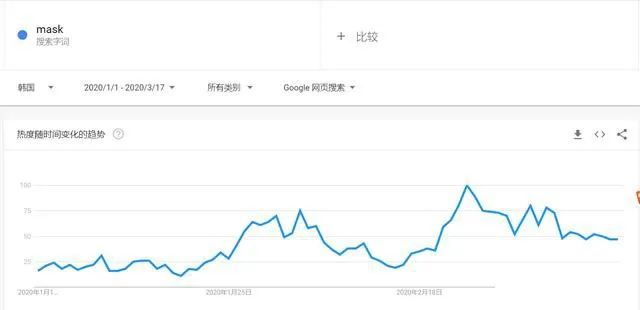
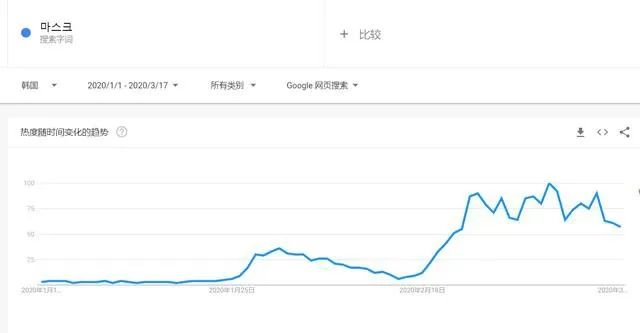
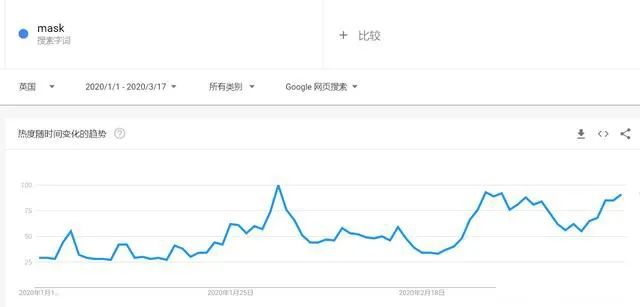
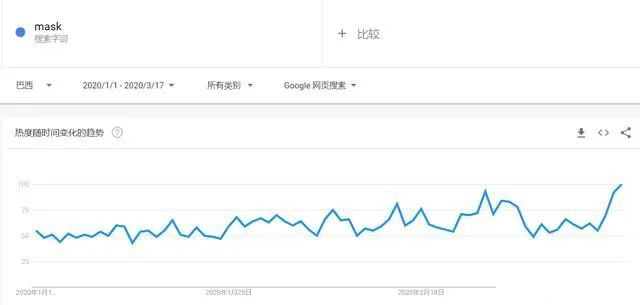
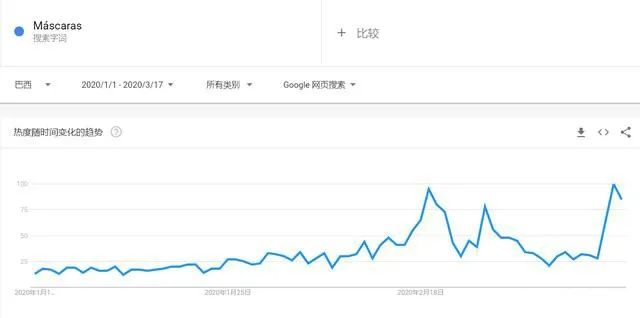
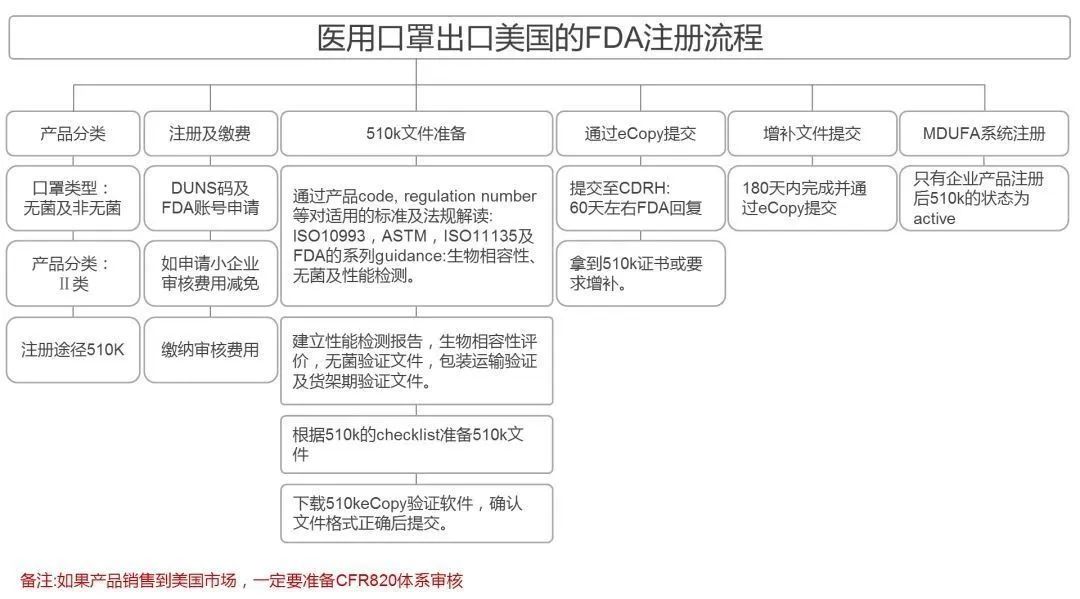
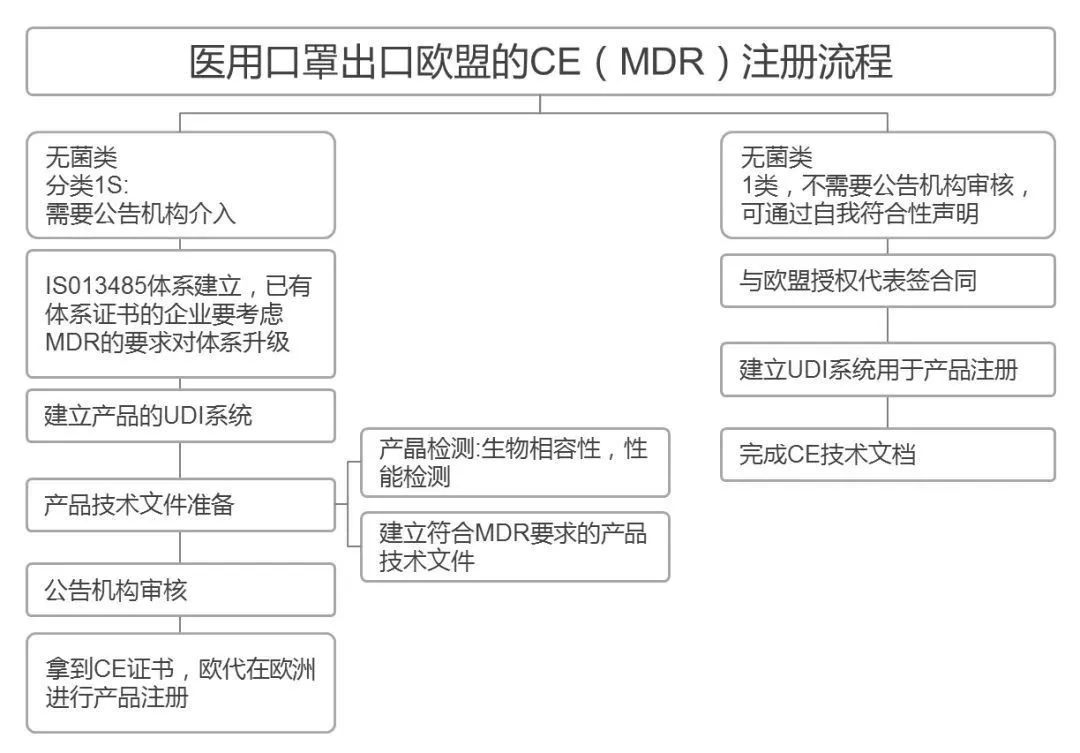
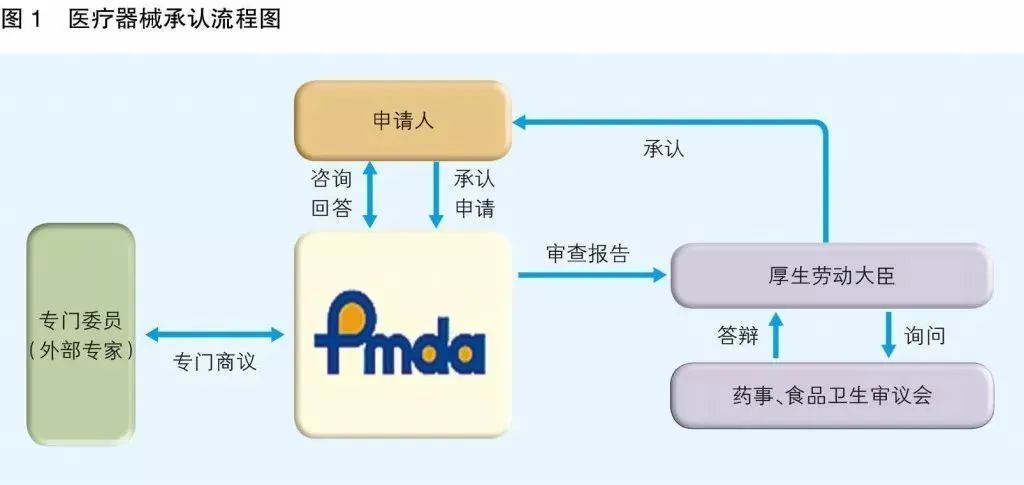
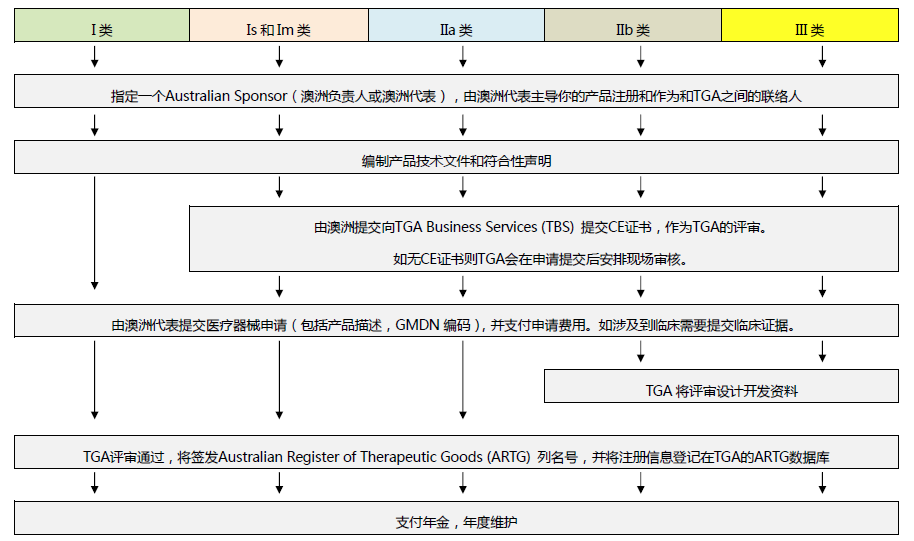
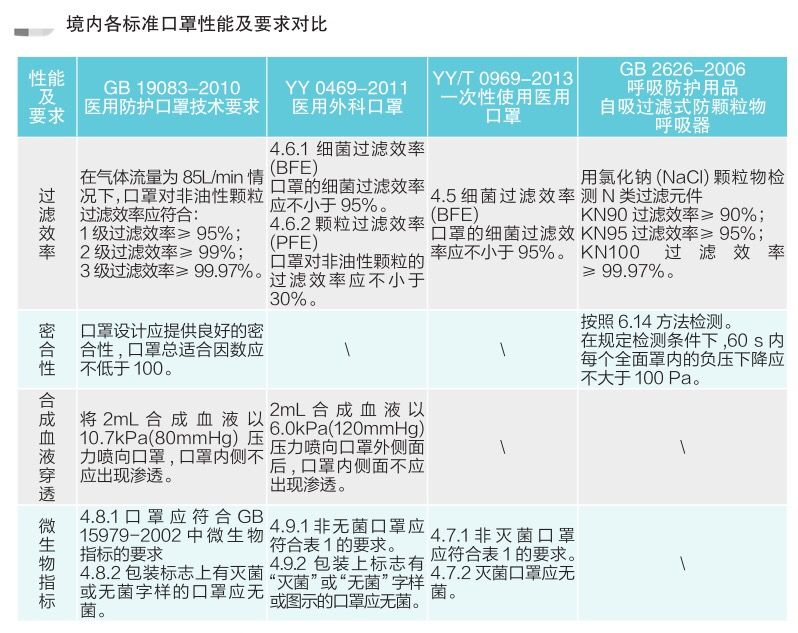
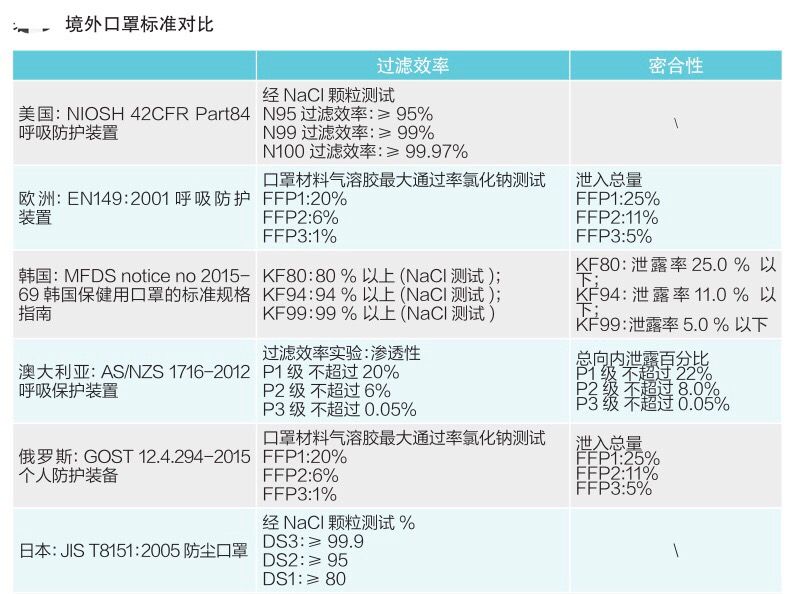
有组来自于网络的数据供大家了解: 2020年2月份以来,我国新增口罩和呼吸防护企业6114家,与去年同期比较,增速高达1561%。我国的口罩产能已经从日常的2500万个左右迅速增加到1亿个以上。 JAC老师利用工具挖掘了一下口罩这个词,mask,的确,数据爆棚。 ▲2020年1月1日到3月17日凌晨趋势图 无论意大利语还是英语搜索,很明显发现实际上从1月31日进入一个小高峰,热度一直没降,2月23日到峰值(意大利红区封城)。 后面因为各方言论的冲突,可能意大利人更加倾向于不戴口罩,热度下降,但是,可惜,事实胜于雄辩,不戴不行。 在空前严重的时候,口罩搜索热度重新上扬。 这真的是理念的大碰撞,最终还是现实说服了他们。 在英国,口罩搜索热度一直很高,而且很明显随着意大利的蔓延,大家对于口罩的搜索一直居高不下。 而最近约翰逊的发言看起来似乎是放弃了抵抗,反而激起了民众的自我防护意识。口罩的搜索热度越来越高。 这个市场,如果大家行动快,这段时间应该是个好机会。 ▲ 巴西热度 3月14日到达热度峰值,因为3月13日有外媒报道巴西总统被确诊,虽然他一直在否认,但是不可否认他的随行人员已经确认,于是整体热度飙升。 ▲ 巴西,葡萄牙语口罩搜索热度 葡萄牙语的搜索,在3月13日已经达到峰值,3月14日开始下降。 其实,当地的居民大部分肯定用当地语言搜索,而用英语搜索的估计很多是一些外来人口,包括很大一部分生意人。 一、出口通关提示 收发货人注册编码(慈善机构可为临时编码),需办理无纸化通关法人卡 口罩出口对生产销售单位、境内发货人,除满足国内生产、市场流通资质需求外,中国海关无特殊资质要求。 1.商品归类:除特殊情况外,绝大部分口罩应归入税号63079000。 2.检验检疫:口罩为非法检产品,申报时检验检疫项目无需填报。根据我国政府与相关国家签订的政府间检验协议,对出口伊朗等少数几个国家的产品需按规定进行装运前检验。 3.关税征免: 4.禁限管理:目前商务部未对口罩设置贸易管制要求,中国海关也无针对防护物资的监管证件口岸验核要求。 5.申报规范:按照规范申报要求填写商品名称、成分含量;如物资非中国生产,原产国按照实际生产国填写。 口罩的出口退税率为13%。 美国企业可申请排除口罩进口加征关税,但是目前只有少数企业获准豁免。 物资出口申报如遇单窗等系统故障,可联系现场海关采取应急方式处置,或者拨打海关12360热线进行咨询。 ↓↓↓以下内容是根据国内外相关↓↓↓ 政府机构、专业网站、新闻报道 收集整理而成,仅供参考。具体内容以 相关管理部门、国外官方机构要求为准。 二、出口前准备 国外按照用途一般分为个人防护和医用两类口罩。 1.营业执照(经营范围有相关经营内容)。 2.企业生产许可证(生产企业)。 3.产品检验报告(生产企业)。 4.医疗器械注册证(非医用不需要)。 5.产品说明书(跟着产品提供)、标签(随附产品提供)。 6.产品批次/号(外包装)。 7.产品质量安全书或合格证(跟着产品提供)。 8.产品样品图片及外包装图片。 9.贸易公司须取得海关收发货人注册备案。 生产个人防护或者工业用非医疗器械管理的普通口罩,有进出口权的企业,可自行直接出口。 生产属于医疗器械管理的口罩用于出口,中国海关不需要企业提供相关资质证明文件,但一般进口国会要求生产企业提供产品三证,以证明该进口的商品在中国已合法上市,具体如下: 1.营业执照(经营范围包含有医疗器械相关,非医疗级别的物品不需要)。 2.医疗器械产品备案证或者注册证。 3. 厂家检测报告。 生产企业有进出口权,可以自行出口,如没有进出口权,可以通过外贸代理进行出口销售。 1. 向市场监管部门取得营业执照,增加经营范围“货物进出口、技术进出口、代理进出口”。 2. 向商务部门取得进出口权,可直接在商务部业务系统统一平台(http://iecms.mofcom.gov.cn/)申请,网上提交材料。 3. 向外汇管理局申请取得开设外汇账户许可。 4. 办理进出口货物收发货人海关注册登记。 三、各国口罩准入条件 产品准入条件 美国 提单,箱单,发票。 必须取得美国 NIOSH检测认证,即National Institute for Occupational Safety and Health美国国家职业安全卫生研究所认证。 须取得美国FDA注册许可。 欧盟 提单,箱单,发票。 医用口罩对应的欧盟标准是EN14683。 产品在欧盟销售需要出具欧盟自由销售证书 Free Sale Certificate,有了CE标志并进行了相关指令中要求的欧盟注册后,中国的制造商出口欧盟不需要自由销售证书。 日本 提单,箱单,发票,日本国外的制造商必须向PMDA注册制造商信息。 包装上印有ウィルスカット(中文翻译:病毒拦截)99%的字样 PFE:0.1um微粒子颗粒过滤效率 BFE:细菌过滤率 VFE:病毒过滤率 1. 医用防护口罩:符合中国GB 19083-2010 强制性标准,过滤效率≥95%(使用非油性颗粒物测试)。 2. N95口罩:美国NIOSH认证,非油性颗粒物过滤效率≥95%。 3. KN95口罩:符合中国GB 2626 强制性标准,非油性颗粒物过滤效率≥95%。 韩国 提单,箱单,发票,韩国进口商营业执照。 KF (Korean filter) 系列分为KF80、KF94、KF99 MFDS Notice No. 2015-69 韩国医疗器械准入的法规门槛,基本分类为I、II、III、IV类,持证为韩国公司(License holder),韩国收货人需要到韩国药监局Korea Pharmaceutical Traders Association. 提前备案进口资质(没有不行)网址:www.kpta.or.kr。 澳大利亚 提单,箱单,发票。 须通过澳洲的TGA注册,符合标准规范:AS/NZS 1716:2012,此规范是澳大利亚和新西兰的呼吸保护装置标准。 TGA是Therapeutic Goods Administration的简写,全称是治疗商品管理局,它是澳大利亚的治疗商品(包括药物、医疗器械、基因科技和血液制品)的监督机构。澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。 四、各国注册、认证简要办理流程 美国NIOSH认证 需按照NIOSH的指南实施,企业需寄送样品至NIOSH实验室实施测试,同时提交技术性资料(包括质量体系部分资料)至NIOSH文审,只有文审和测试都通过,NIOSH才核发批文。NIOSH将其认证的防颗粒物口罩分为9类,具体的测试则由NIOSH下属的NPPTL (National Personal Protective Technology Laboratory)实验室操作。主要测试指标包括呼气阻力测试、呼气阀泄漏测试、吸气阻力测试、过滤效率测试。 美国FDA注册 欧盟CE注册 日本PMDA注册 1. 准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择MAH(日本持证方); 2. 制造商向PMDA注册工厂; 3. II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书; 4. 申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW(厚生劳动省)发证; 5. 支付申请费用; 6. 注册文件整改,注册批准; 7. 所有类别产品均需要MAH向RBHW(厚生省地区机构)进行进口通报注册后才能进口销售。 韩国KFDA注册 韩国卫生福利部(MinistryofHealthandWelfare,MHW),简称卫生部,主要负责管食品、药品、化妆品和医疗器械的管理,是最主要的卫生保健部门。依照《医疗器械法》,韩国卫生福利部下属的食品药品安全部负责对医疗器械的监管工作。KFDA注册流程为: 1. 确定产品分类(I,II,III,IV),选择KLH(韩国持证方); 2. II类产品需申请KGMP证书和接受现场审核,II类产品一般是授权的第三方审核员,并获得KGMP证书; 3. II类产品需要送样品到韩国MFDS授权的实验室进行韩国标准的测试; 4. 由KLH向MFDS(韩国食品药品安全部)提交技术文件(检测报告,KGMP证书等),进行注册审批; 5. 支付申请费用; 6. 注册文件整改,注册批准; 7. 指定韩国代理商和经销商,产品销售。 澳大利亚TGA注册 依据Australian Therapeutic Goods (Medical Devices) Regulations 2002,澳大利亚对医疗器械分为I类,Is and Im, IIa, IIb, III类,产品的分类几乎和欧盟分类一致,如果产品已经获得CE标志,则产品类别可以按照CE分类。如果已经获得欧盟公告机构(Notified Body)签发的CE证书,是可以被TGA认可的,并可以作为满足澳大利亚安全法规的重要注册资料。 五、各国口罩技术标准对比 (供生产企业参考) 六、各国口罩技术标准 (供生产企业参考) 序号 标准号 标准名称 状态 发布时间 国际 ISO 22609:2004 传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积,水平注射) 现行 2004/12/3 欧盟 EN 136-1998 呼吸保护装置.全面罩.要求,试验,标记。 现行 1998/1/1 EN 140-1998 AC-1999 呼吸保护装置.半面罩和四分之一面罩.要求,试验和标记。 现行 1998/9/1 EN 143-2000 呼吸防护装置.微粒过滤器.要求,试验,标记。 现行 2000/2/1 EN 149-2001 呼吸防护装置.颗粒防护用过滤半面罩.要求,检验和标记。 现行 2001/4/1 EN 529-2005 呼吸保护装置.选择,使用,保养和维修的建议。 现行 2005 EN 12942-1998 呼吸保护器.带全面罩,半面罩和四分之一面罩的鼓风过滤装置.要求,检验,标识。 现行 1998 EN 14387-2004 A1-2008 呼吸保护装置.气体过滤器和组合过滤器.要求、测试、标记。 现行 2004/1/1 EN 14683-2019 医用口罩 要求和试验方法。 现行 2019/3/1 美国 ASTM F1862/F1862M-2017 医用口罩抗人工合成血渗透的标准试验方法(已知速度下固定体积的水平投影)。 现行 2017 ASTM F2100-2019 医用口罩材料性能标准规范。 现行 2019 ASTM F2101-2019 用金黄色葡萄球菌生物气溶胶评价医用口罩材料的细菌过滤效率(BFE)的标准试验方法。 现行 2019 ASTM F2299/F2299M-2003(2017) 用胶乳球测定医用面具材料粒子渗透性初始效率的标准试验方法。 现行 2003 澳大利亚 AS/NZS 1715:2009 呼吸保护设备的选择,使用和维护。 现行 2009/2/6 AS/NZS 1716:2012 呼吸保护装置。 现行 2012/2/13 日本 JIS T 8062:2010 预防传染性病原体的防护服.面罩.防止人造血浆渗透的试验方法(确定容量,平行注射)。 现行 2010/5/25 JIS T 8159:2006 呼吸防护设备的选择、使用和维护指南。 现行 2006/4/25 JIS T 8159:2006 呼吸保护装置泄漏率试验方法。 现行 2006/2/20 韩国 KS M 6673-2008 防尘口罩 现行 2008/2/22 KS K ISO 22609-2018 传染试剂防护服.医疗面罩.防人造血渗透的试验方法(固定容积、水平喷射)。 现行 2018/11/14 *以上技术标准如有动态调整,以相关标准管理机构官方发布为准。 | 本文综合整理自12360海关热线,关务小二,JAC外贸实战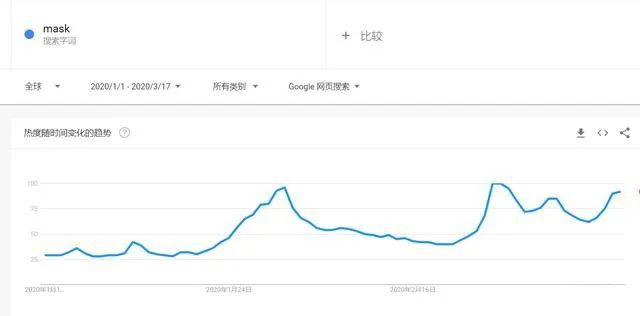
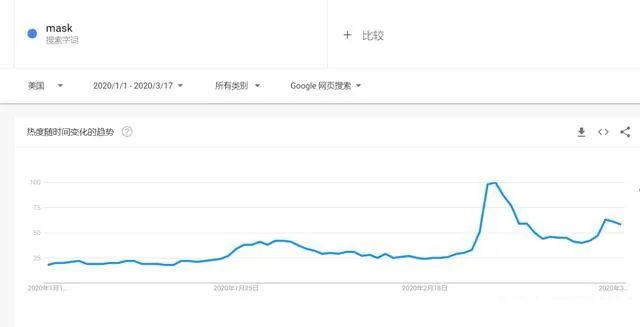 ▲ 美国数据很奇葩
▲ 美国数据很奇葩